Rupture du ligament croisé antérieur : le chat aussi !
Bien que beaucoup moins fréquente que chez le chien, une rupture du ligament croisé antérieur isolée peut se produire chez le chat. Le présent article reprend des éléments de diagnostic et de traitement de cette affection qui doit être incluse dans le diagnostic différentiel des boiteries du membre postérieur dans cette espèce.
Les ruptures du ligament croisé crânial (LCCr) chez le chat sont beaucoup moins fréquentes que dans l’espèce canine. Ainsi, alors que la littérature scientifique abonde dans le cas du chien, les articles de référence concernant la conduite à tenir face à une rupture du LCCr chez le chat sont denrée rare.
Une étude (6) rétrospective sur 17 cas de rupture permet d’avoir une vue d’ensemble de la conduite à tenir. D’une manière générale, la rupture du LCCr chez le chat concernerait davantage des animaux d’âge intermédiaire (8,5 ans), plutôt d’un poids supérieur à la moyenne de l’espèce féline, avec une association fréquente à d’autres lésions ligamentaires du grasset bien que de des ruptures isolées ne soient pas considérées comme rares.
Certains auteurs soupçonnent aussi une corrélation positive avec l’hyperthyroïdie féline et la cardiomyopathie hypertrophique (7,9). Enfin, une étude conduite dans l’espèce féline (13) a montré une augmentation modérée (3,1) de l’angle du plateau tibial mesuré par la méthode de Slocum dans une population de chats présentant une rupture du LCCr par rapport à une population féline de référence.
Le diagnostic se fait de manière identique à l’espèce canine et repose sur la mise en évidence du signe du tiroir antérieur positif. De la même manière que dans l’espèce canine, une douleur lors de l’hyperextension du grasset peut orienter vers une affection du LCCr. Le signe du tiroir est alors à rechercher : il peut être mis en évidence soit de manière directe par taxis, soit de manière indirecte (avancement de la crête tibiale lors de l’hyperflexion du jarret, grasset à 90°).
Vidéo 1 : Mise en évidence du signe du tiroir.
Comme chez le chien, il est recommandé de réaliser des clichés radiographiques avant d’entreprendre toute intervention. Ceci permet de rechercher des affections associées, principalement tumeurs osseuses ou fractures, de confirmer le signe du tiroir indirect, de rechercher des signes d’avulsion de l’insertion du LCCr, de juger de la présence d’arthrose, et enfin de mesurer l’angle du plateau tibial qui, comme dans l’espèce canine, peut présenter une angulation excessive et orienter le choix de la technique chirurgicale (ostéotomie correctrice notamment par closing wedge osteotomy lors d’angulation importante (> 30-35°) du plateau tibial).
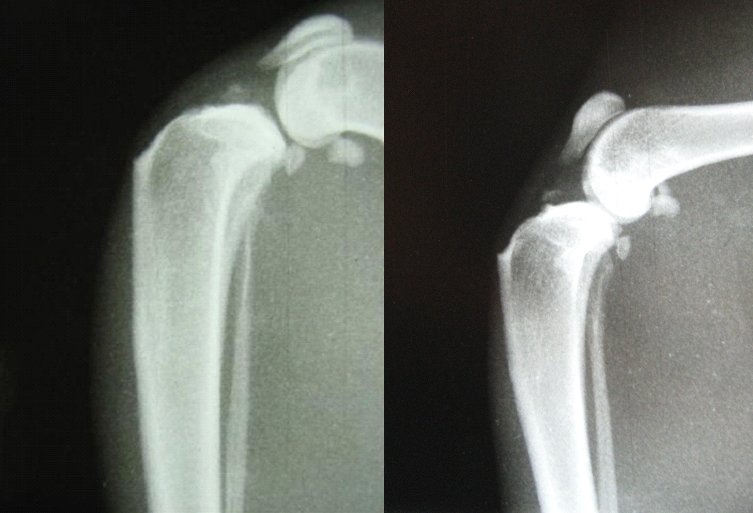
Lors des radiographies, il est fréquent de rencontrer des calcifications intra-articulaires qui peuvent être confondues avec une lésion d’avulsion de l’insertion tibiale du LCCr (Fig.1).
On peut soupçonner une minéralisation du corps du LCCr afin d’expliquer ce type d’image mais, contrairement au chien où nombre d’études ont soumis des LCCr rompus à examen anatomopathologique, il existe peu de telles études dans l’espèce féline. Un article (7) fait référence à une telle analyse histologique des LCCr rompus chez le chat: il montreraient, de manière similaire à ce qui est communément observé chez le chien, un arrangement irrégulier des fibres de collagène, une prolifération des fibroblastes et occasionnellement une minéralisation dystrophique. Il serait à ce titre intéressant de pouvoir corréler la prévalence de telles lésions du LCCr du chat à la survenue de sa rupture.
Par ailleurs, le même article mentionne une prévalence supérieure dans l’espèce féline des phénomènes de minéralisation dystrophique, l’auteur signalant que la celle-ci est la plupart du temps localisée à proximité du point d’insertion du LCCr sur le tibia crânial.
La conduite à tenir face à une rupture du LCCr chez le chat diffère selon les intervenants. Certains recommandent un traitement conservateur avec mise au repos de l’animal pendant 6 semaines et administration d’AINS avec un résultat fonctionnel acceptable dans 70% des cas environ. A l’issue de ce délai, si le retour en fonction n’est pas satisfaisant, une intervention chirurgicale est alors proposée.
Cette attitude conservatrice peut prêter à discussion dans la mesure où les chats étant des animaux par nature assez actifs, des lésions de dégénérescence articulaire dues à l’instabilité du grasset sont sans doute susceptibles de survenir à terme. En effet, comme dans l’espèce canine, l’angulation du plateau tibial chez le chat provoque, lors de la phase d’appui, une poussée tibiale crâniale (crânial tibial trust), dont la conséquence principale est de déplacer caudalement la surface d’appui des condyles fémoraux sur les cornes méniscales postérieures (12,14). Il semble donc logique de penser que des lésions méniscales potentiellement douloureuses ou invalidantes surviennent de la même manière que chez le chien en cas d’instabilité prolongée de l’articulation du grasset (2).
De même, les forces de contact fémoropatellaires après transsection du LCCr chez le chat sont modifiées et peuvent être à l’origine de lésions dégénératives des cartilages articulaires (8).
Enfin, des études (1,3,4,5) conduites chez le chat ont montré l’intérêt d’une stabilisation du grasset dans la récupération musculaire et nerveuse péri- articulaire, ce qui limiterait, selon les auteurs, les phénomènes de perte de proprioception et de dystrophie musculaire associés à cette pathologie lors de traitement conservateur.
Aussi, nombre d’orthopédistes proposent-ils un traitement chirurgical d’emblée, toutefois un traitement conservateur est une possibilité parfaitement valable dans la mesure où le chat est réévalué un mois après le diagnostic initial.
Vidéo 2 : traitement CONSERVATEUR avec perte de poids. Les deux LCA sont rompus avec 1er côté rompu depuis plus de 4 ans. La démarche est apparemment normale, le chat mène une vie active en extérieur sans boiterie.
Le traitement chirurgical de la rupture du LCCr chez le chat fait généralement appel à des techniques extracaspulaires comme chez le chien de petit format. Cependant, l’angulation du plateau tibial doit être considérée dans le choix de cette technique. En effet, si celle-ci est excessive, le choix d’une telle technique peut être décevant. Un cas (10) est rapporté dans la littérature d’un chat avec rupture du LCCr associée à une angulation de 70° du plateau tibial ayant nécessité la réalisation d’une ostéotomie correctrice.
Une arthrotomie latérale est réalisée après abord par incision du fascia lata. La patelle est luxée médialement afin d’exploser l’articulation. Une arthrotomie médiale peut constituer une alternative.
Les restes du LCCr rompu sont excisés (Fig.2). Un mini écarteur à grasset ou un levier de Hohman permet d’explorer l’articulation afin d’apprécier l’état des ménisques: une méniscectomie partielle ou totale est indiquée lors d’atteinte méniscale. Comme chez le chien, l’usage d’un crochet palpeur de petite taille est conseillé afin de juger au mieux de l’état et de la tenue des ménisques.
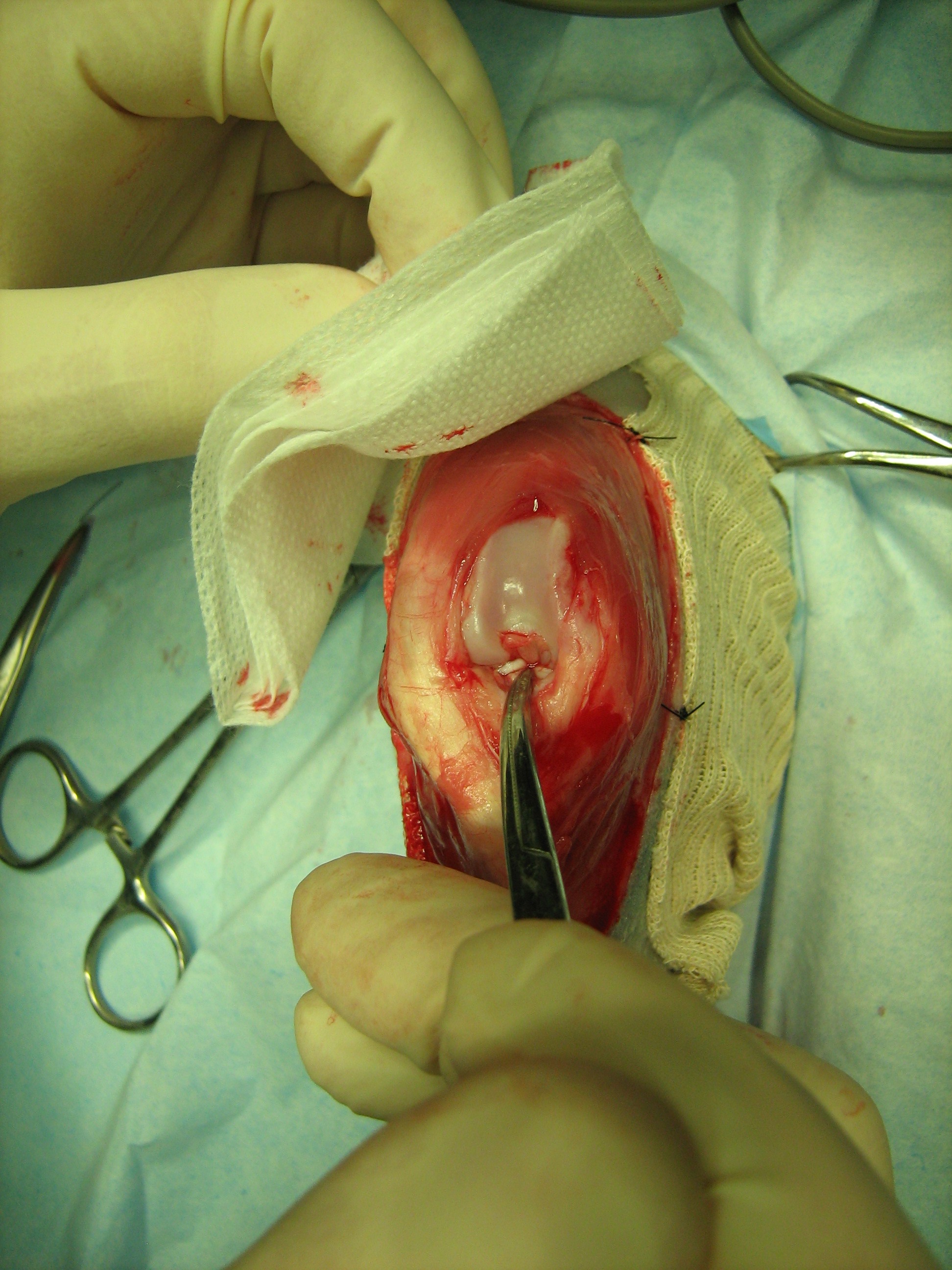
Figure 2 : vue peropératoire.
Après débridement, l’articulation est rincée au sérum physiologique, puis refermée par des points simples au fil résorbable de petite décimale. Il est conseillé chez le chat de ne pas faire de suture en tension de la capsule articulaire afin de ne pas induire de tensions latérales sur la patelle : les sutures doivent être apposantes. L’instillation intra-articulaire de lidocaïne avant fermeture est conseillée.
L’articulation est ensuite stabilisée au moyen d’une prothèse synthétique extra-capsulaire sertie sur aiguille. Le chef latéral du muscle poplité est repéré ainsi que son insertion sur la fabelle et le ligament femoro fabellaire. La prothèse est tout d’abord passée sous le muscle poplité disto-proximalement, puis passée proximo-distalement dans le corps du ligament fémoro-fabellaire dont la solidité assurera la tenue de la prothèse en tension. Le positionnement du passage prothétique dans le corps du ligament fémoro-fabellaire est un temps fondamental : la solidité de l’ancrage doit être évaluée. On doit pouvoir littéralement soulever l’animal par la prothèse sans que les brins ne se rapprochent. La prothèse est ensuite passée sous le tendon rotulien en veillant à rester en position extra articulaire.
Le muscle tibial crânial est élevé par dépériostage, pus un forage osseux d’un diamètre légèrement supérieur à celui de la prothèse est réalisé sous le plateau tibial parallèlement à la surface articulaire. La position du forage est importante. On recherche un forage le plus proximal et caudal possible afin de positionner la prothèse dans la position la plus isométrique possible (i.e. : reproduisant la trajet du LCCr).
Les deux brins de la prothèse sont ensuite ramenés parallèlement et la prothèse est mise en tension manuellement tout en mobilisant le grasset en flexion-extension. La prothèse est ensuite bloquée avec la tension adéquate, soit au moyen d’un laçage, ou mieux d’un tube à sertir prévu à cet effet. Il est fondamental d’appliquer à la prothèse un tension suffisante pour éliminer le tiroir crânial tout en évitant d’appliquer une tension excessive. En effet, l’excès de tension est tout aussi délétère que son insuffisance. Il est généralement convenu que la tension à appliquer doit être juste légèrement supérieure à celle qui permet de vaincre le tiroir car un relâchement va survenir lors de la remise en charge du membre (écrasement des tissus par la prothèse).
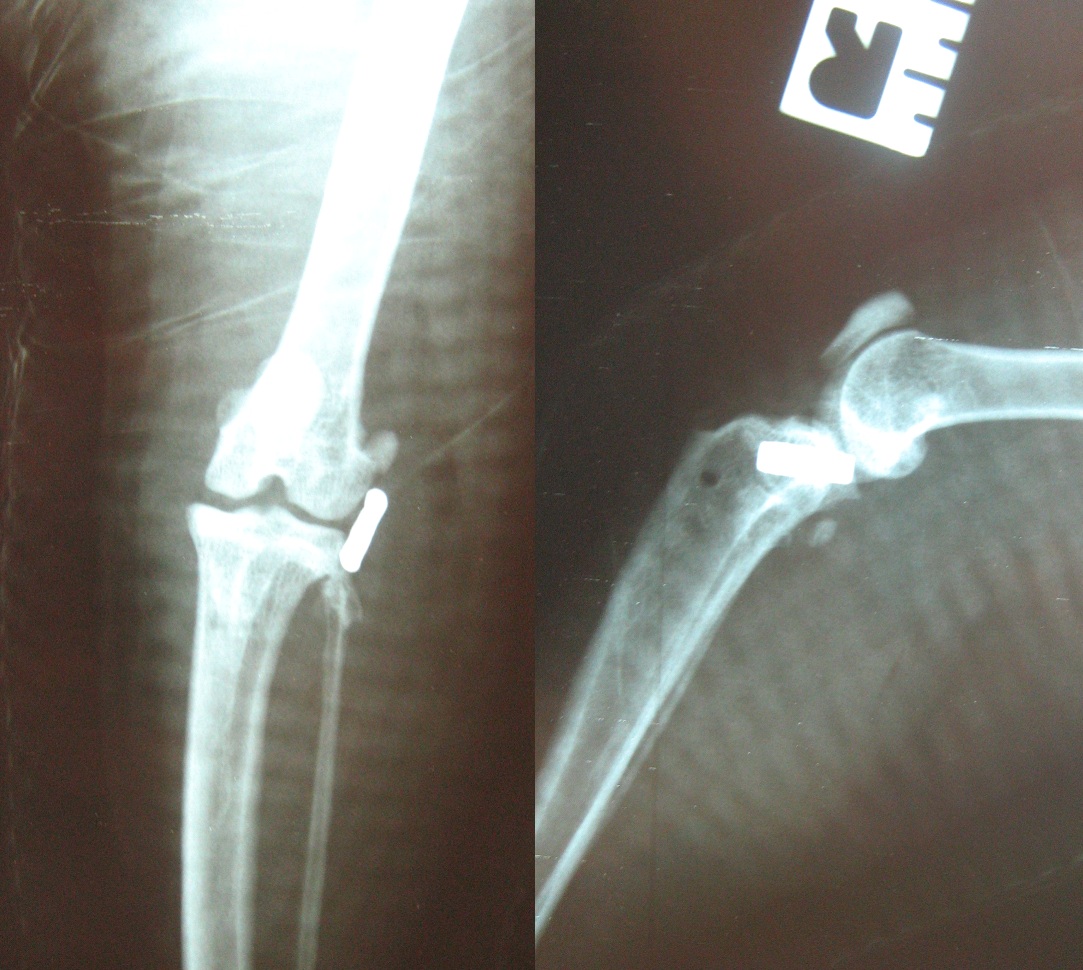
En effet, un excès de tension va conduire à une gêne articulaire, une déviation en rotation externe du tibia et parfois la rupture pure et simple de l’implant. Des dispositifs de tension possédant un arrêt fileté ou cranté, commercialisés à cet effet , facilitent grandement la recherche de cette tension « idéale » (Fig.3).
L’articulation est alors mobilisée plusieurs fois en flexion extension et rotation afin de vérifier que la tension des prothèses ne gêne pas l’amplitude normale de l’articulation. Le signe du tiroir est encore recherché : il doit être négatif. Le site chirurgical est ensuite refermé classiquement plan par plan.
Chez le chat, il n’est pas conseillé de placer un pansement contentif de type Robert-Jones en postopératoire. En effet, le chat aura tendance à vouloir retirer ce dernier par maintes circonvolutions acrobatiques.
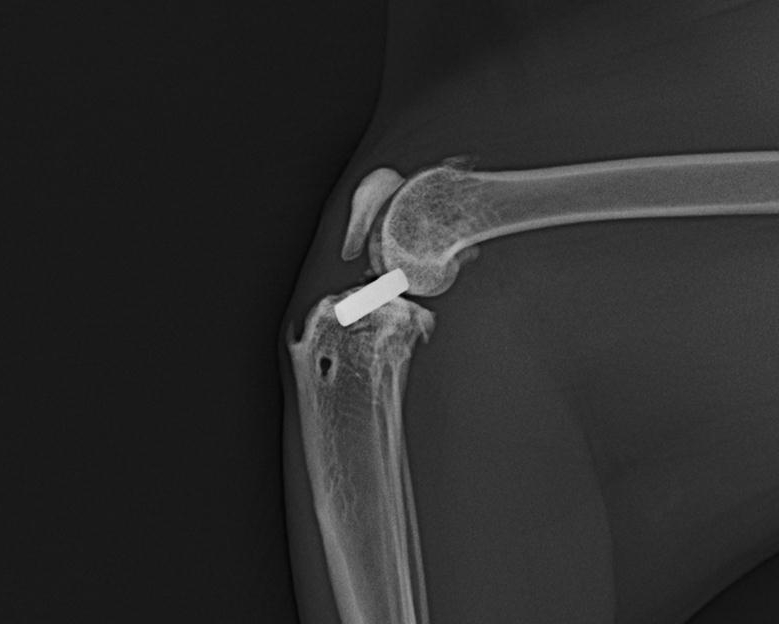
Un contrôle de stabilité est effectué au retrait des fils. Un contrôle à un mois et demi environ postopératoire permet de s’assurer de la bonne tenue de la prothèse (Fig.4). L’évolution à plus long terme se fait généralement dans le sens d’une fibrose péri-prothétique (effet « corps étranger » de la prothèse) qui va contribuer à épauler voire relayer la stabilité initialement assurée par la seule prothèse. Il est généralement considéré que plusieurs mois de restriction d’exercice permettent l’installation de cette fibrose de relais en conservant la tension initiale.
Vidéo 3 : même chat quatre mois postopératoires.
Les complications attendues lors de stabilisation extracapsulaire chez le chat sont les mêmes que chez le chien : réapparition du tiroir par détente ou rupture de prothèse, sepsis et infection du matériel prothétique (privilégier les prothèses de type monofilament), lésions méniscales tardives, arthrose… Ces complications peuvent donner lieu à une reprise chirurgicale.
Bibliographie
1) Bonsfills N., Raygoza J.-J., Boemo E., Garrido J., Núñez A., Gómez-Barrena E. : Proprioception in the ACL-ruptured knee – The contribution of the medial collateral ligament and patellar ligament. An in vivo experimental study in the cat. Knee, 2007 Jan.; 14(1) : 39-45. Epub 2006 Oct 27.
2) Flo G.-L. : Meniscal injuries. Vet. Clin. North. Am. Small Anim. Pract., 1993 Jul.; 23(4) : 831-43.
3) Gómez-Barrena E., Bonsfills N., Martín J.-G., Ballesteros-Massó R., Foruria A., Núñez-Molina A : Insufficient recovery of neuromuscular activity around the knee after experimental anterior cruciate ligament reconstruction. Acta Orthop., 2008 Feb.; 79(1) : 39-47.
4) Gómez-Barrena E., Nuñez A., Ballesteros R., Martinez-Moreno E., Munuera L. : Anterior cruciate ligament reconstruction affects proprioception in the cat’s knee. Acta Orthop. Scand., 1999 Apr.; 70(2) : 185-93.
5) Gómez-Barrena E., Nuñez A., Martinez-Moreno E., Valls J., Munuera L. : Neural and muscular electric activity in the cat’s knee. Changes when the anterior cruciate ligament is transected. Acta Orthop. Scand., 1997 Apr.; 68(2) : 149-55.
6) Harasen G.-L. Feline cranial cruciate rupture : 17 cases and a review of the literature. Vet. Comp. Orthop. Traumatol., 2005; 18(4) : 254-7.
7) Harasen G. : Feline cruciate rupture. Can. Vet. J., 2007 Jun.; 48(6) : 639-40.
8) Hasler E.-M., Herzog W. : Quantification of in vivo patellofemoral contact forces before and after ACL transection. J. Biomech., 1998 Jan.; 31(1) : 37-44.
9) Janssens L.-A., Janssens G.-O., Janssens D.-L. : Anterior cruciate ligamnet rupture associates with cardiomyopathy in three cats. Vet. Com. Orthop. Traumatol., 1991; 4 : 35-37
10) Hoots E.-A-, Petersen S.-W. : Tibial plateau leveling osteotomy and cranial closing wedge ostectomy in a cat with cranial cruciate ligament rupture. J. Am. Anim. Hosp. Assoc., 2005 Nov.-Dec.; 41(6) : 395-9.
11) Kunkel K.-A., Basinger R.-R-, Suber J.-T-, Gerard P.-D. : Evaluation of a transcondylar toggle system for stabilization of the cranial cruciate deficient stifle in small dogs and cats. Vet. Surg., 2009 Dec.; 38(8) : 975-82.
12) Maitland M.-E., Leonard T., Frank C.-B., Shrive N.-G., Herzog W. : Longitudinal measurement of tibial motion relative to the femur during passive displacements in the cat before and after anterior cruciate ligament transection. J. Orthop. Res., 1998 Jul.; 16(4) : 448-54.
13) Schnabl E., Reese S., Lorinson K., Lorinson D. : Measurement of the tibial plateau angle in cats with and without cranial cruciate ligament rupture. Vet. Comp. Orthop. Traumatol., 2009; 22(2) : 83-6.
14) Umphlet R.-C. Vet. : Feline stifle disease. Clin. North. Am. Small Anim. Pract., 1993 Jul.; 23(4) : 897-913.
Mots-clefs : chat, genou, grasset, ligament croisé, rlca, rotule, rupture